近日,江蘇省藥品監督管理局發布的通知顯示,揚州慧科電子有限公司(以下簡稱“揚州慧科”)和蘇州貝茵科技股份有限公司(以下簡稱“蘇州貝茵”)因公司質量管理體系存在嚴重缺陷,被采取暫停生產風險控制措施。
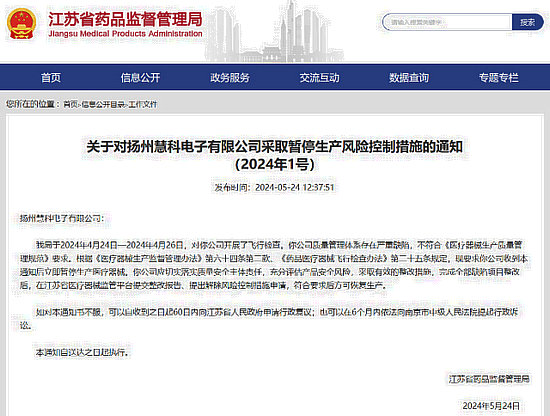
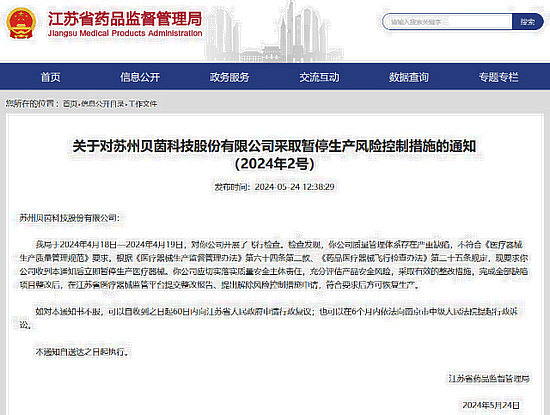
通知中稱,2024年4月18日—19日,江蘇省藥品監督管理局對揚州慧科和蘇州貝茵開展飛行檢查發現,上述兩家公司質量管理體系不符合《醫療器械生產質量管理規范》要求。
通知指出,上述兩家公司在收到通知后應立即暫停生產醫療器械,并切實落實質量安全主體責任,充分評估產品安全風險,采取有效的整改措施,完成全部缺陷項目整改后,在江蘇省醫療器械監管平臺提交整改報告、提出解除風險控制措施申請,符合要求后方可恢復生產。
對于通知要求暫停生產的醫療器械都包含什么?已售出產品是否存在安全風險,整改措施有哪些項目等問題,揚州慧科相關工作人員對新華網表示,公司與江蘇省藥監局對接,執行他們的要求,不便回答這些問題。
蘇州貝茵相關工作人員則表示,會向公司上級反應,但負責人員能否作答、何時作答無法確定;后續再詢問時,電話一直提示“正在通話中”而無法接通。
公開資料顯示,揚州慧科成立于2003年5月,主要從事電子產品、醫療器械和實驗設備的開發和生產,有自動洗胃機、電動吸引器、腳踏吸引器、電動吸痰機等醫療類產品。蘇州貝茵成立于2003年7月,主要產品包含實驗分析儀器,制冷、空調設備,智能儀器儀表等醫療類產品。
值得注意的是,早在2022年9月,江蘇省藥品監督管理局對存在質量抽驗不合格,不良事件、投訴舉報多,以及質量體系運行差等情況的34家醫療器械生產企業進行交叉飛行檢查時,揚州慧科等9家企業曾被申請暫停生產并進行整改。
另外,2023年8月國家藥監局發布的《關于發布國家醫療器械監督抽檢結果的通告》顯示,蘇州貝茵曾因生產的電動吸引器不符合“由網電源驅動、可移動的高負壓/高流量設備”標準規定,并責令整改。
編輯:郭成










